Atominės masės ir atomų skaičiaus santykis
Turinys
- Turinys: skirtumas tarp atominės masės ir atominio skaičiaus
- Kas yra atominės mišios?
- Kas yra atominis skaičius?
- Pagrindiniai skirtumai
Atominė masė ir atominiai skaičiai yra du terminai, plačiai naudojami chemijos ir fizikos sąvokose. Norint suprasti pagrindines mokslo sąvokas, abi šios sąvokos turi didelę reikšmę. Dažniausiai šie du terminai žmonėms kelia painiavą, jie abu keičiasi. Tačiau jie labai skiriasi vienas nuo kito, nors abu šie terminai turi tam tikrų panašumų, tačiau skiriasi vienas nuo kito. Skirtingų medžiagų, medžiagų ir elementų savybės ir savybės negali būti suprantamos suprantant šių terminų reikšmes. Atominis skaičius naudojamas norint aiškiai apibrėžti, kokio tipo elementas yra medžiaga, o gal ir medžiaga. Jis apibūdinamas ir apibūdinamas kaip protonų, esančių elemento branduolio šaltinyje, skaičius, tuo tarpu, kita vertus, atominė masė yra neabejotinai skaičius, susijęs tiek su protonais, tiek su neutroniais, esančiais tam tikrame branduolio elemente, susijusiame su elementu. Elektronai iš tikrųjų sveria nedaug, todėl atominė masė iš tikrųjų nustatoma pridedant neutronams protonų kiekį. Be to, jis žinomas kaip atominis svoris.

Turinys: skirtumas tarp atominės masės ir atominio skaičiaus
- Kas yra atominės mišios?
- Kas yra atominis skaičius?
- Pagrindiniai skirtumai
- Vaizdo įrašo paaiškinimas
Kas yra atominės mišios?
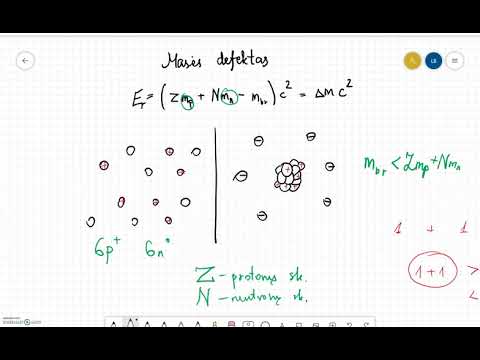
Masės numeris arba žinomas kaip atominės masės numeris žymimas (A), paprastai rašomas viršutinėje elemento pusėje, jis taip pat vadinamas atominės masės skaičiumi, o gal nukleono skaičiumi, neabejotinai yra galutinis protonų ir neutronų (kurie kartu vadinami nukleonais) atominiame branduolyje. Ji nustato konkrečią atomų masę. Dėl protonų fakto, taip pat ir nuo neutronų, jie abu yra baronai, todėl tam tikras masės skaičius A yra panašus kaip ir barionų skaičius B, nes tam tikras viso atomo branduolys ar net jonai. Masių skaičius yra visiškai skirtingas kiekvienam atskiram cheminės medžiagos komponento izotopui. Tai paprasčiausiai nėra tas pats, kaip atominis skaičius (Z). Masės numeris kartais pateikiamas pagal elemento pavadinimą arba galimai kaip viršuje esantis ženklas kairėje nuo jūsų elemento simbolio. Pavyzdžiui, tipiškiausias izotopas, į kurį įeina anglis, neabejotinai yra anglies-12 arba 12C, į kurį įeina 6 protonai ir 6 neutronai. Visas izotopų ženklas tikrai turėtų atominį skaičių. Masės skaičiaus nereikėtų painioti su kitu panašiu terminu, kuris yra santykinė elemento atominė masė.
Kas yra atominis skaičius?
Atominis skaičius žymimas „Z“. Kalbant apie chemiją ir fiziką, paprastai atominis skaičius, susijęs su cheminiu elementu (dar vadinamas protono skaičiumi), yra neabejotinai protonų skaičius, esantis tobulai branduolyje, susijusiame su to elemento atomu, ir dėl šios priežasties panašus į konkretaus branduolio įkrovos numerį. Jį iš tikrųjų tradiciškai simbolizuoja vaizdas Z. Atominis skaičius išimtinai nulemia cheminį elementą. Neįkrauto atomo konkretus atominis skaičius taip pat yra palyginamas su elektronų skaičiumi. Atomo skaičius Z turi sustoti neteisingai nurodytas kaip masės numeris A, kuris yra nukleonų skaičius, neutronų skaičius N, yra pripažįstamas kaip neutronų skaičius, susijęs su atomu; todėl A = Z + N (visos šios sumos visada bus sveikieji skaičiai). Kadangi protonų ir neutronų masė turi beveik vienodą masę (taip pat elektronų masė neabejotinai yra nereikšminga daugeliui tikslų), be to, masės problema, susijusi su nukleono jungimu, paprastai yra mažesnė, palyginti su konkrečia nukleono mase, atominė masė atomas, kai nurodomas atskirų atominių masių vienetų viduje. Atomai, turintys lygiai tą patį atominį skaičių Z, tačiau atskiri neutronų skaičiai N, taigi ir skirtingos atominės masės, yra klasifikuojami kaip izotopai.
Pagrindiniai skirtumai
- Atominį skaičių žymi „Z“, tuo tarpu atominę masę žymi „A“.
- Atominė masė neapibrėžia elemento tipo, tuo tarpu atominė masė apibūdina elemento tipą.
- Atominė masė naudojama parodyti skirtingus to paties elemento izotopus, tuo tarpu atominis skaičius tai netaikomas.
- Atominė masė matuojama atominės masės vienetu (amu), tuo tarpu atominis skaičius yra tik skaičius.
- Elektronų skaičius visada yra lygus atomo skaičiui, bet nėra lygus masės skaičiui.
- Jei atominis skaičius yra didelis, tai reiškia, kad atominė masė taip pat bus didelė.





